Selamat datang di kelas XII , bapak ucapkan selamat kepada kalian semua telah bisa menuntaskan belajar di kelas XI, sehingga kalian bisa melanjutkan di kelas XII, mudah-mudah selama setahun kedepan kalian tetap semangat mengikuti pelajaran kimia (meski secara online)
Baiklah pertemuan pertama kita di kelas XII kali ini kita akan bahas SIFAT KOLIGATIF LARUTAN. Setelah mengikuti materi ini nanti kalian akan di uji pengetahuan sampai dimana kalian memahani materi ini. silahkan di simak paparan materi berikut!
------------------------------------------------------------------------------------------
Pernahkan kalian memanaskan air dengan air teh, mana yang lebih cepat mendidih?? atau di dalam kehidupan kalian, pernahkan kalian melihat di acara-acar pesta seseorang memasukkan sendok kedalam Kancah masakan daging saat memasak, untuk apa hal tersebut dilakukan??
nah agar memahami kejadian tersebut mari kita lihat peristiwa yang disebut dengan SIFAT KOLIGATIF LARUTAN
PENGERTIAN SIFAT KOLIGATIF LARUTAN
Sifat koligatif larutan adalah sifat-sifat yang hanya bergantung pada jumlah (kuantitas) partikel zat terlarut dalam larutan dan tidak bergantung pada jenis atau identitas partikel zat terlarut – tidak peduli dalam bentuk atom, ion, ataupun molekul. Sifat koligatif merupakan sifat yang hanya memandang “kuantitas”, bukan “kualitas”.
dari kejadian diatas, air lebih cepat memdidih dibandingkan air teh, kenapa? karena jumlah partikel air teh lebih banyak dibandingkan air biasa, sehingga sifat koligatif larutan air teh lebih tinggi titik didihnya dibandangkan air biasa
kenapa sendok dimasukkan dalam kancah masakan daging saat memasak, karena daging air di rebus/dimasak dengan titik didih tinggi akan lebih terasa empuk dibandingkan jika titik didih rendah, penambahan sendok di dalam masakan saat memasak tersebut membuat titik didih gulai semakin besar
JENIS SIFAT KOLIGATIF LARUTAN
1. Penurunan Tekanan Uap
Jika zat terlarut bersifat non-volatil (tidak mudah menguap; tekanan uapnya tidak dapat terukur), tekanan uap dari larutan akan selalu lebih rendah dari tekanan uap pelarut murni yang volatil. Secara ideal, tekanan uap dari pelarut volatil di atas larutan yang mengandung zat terlarut non-volatil berbanding lurus terhadap konsentrasi pelarut dalam larutan
2. Kenaikan Titik Didih
Titik didih dari suatu larutan adalah temperatur ketika tekanan uapnya sama dengan tekanan eksternal. Oleh karena terjadinya penurunan tekanan uap larutan oleh keberadaan zat terlarut non-volatil, dibutuhkan kenaikan temperatur untuk menaikkan tekanan uap larutan hingga sama dengan tekanan eksternal
3. Penurunan Titik Beku
Pada larutan dengan pelarut volatil dan zat terlarut non-volatil, hanya partikel-partikel pelarut yang dapat menguap dari larutan sehingga meninggalkan partikel-partikel zat terlarut. Hal serupa juga terjadi dalam banyak kasus di mana hanya partikel-partikel pelarut yang memadat (membeku), meninggalkan partikel-partikel zat terlarut membentuk larutan yang konsentrasinya lebih pekat
4. Tekanan Osmosis
Ketika dua larutan dengan konsentrasi yang berbeda dipisahkan oleh suatu membran semipermeabel — membran yang hanya dapat dilewati partikel pelarut namun tidak dapat dilewati partikel zat terlarut—maka terjadilah fenomena osmosis. Osmosis adalah peristiwa perpindahan selektif partikel-partikel pelarut melalui membran semipermeabel dari larutan dengan konsentrasi zat terlarut yang lebih rendah ke larutan dengan konsentrasi zat terlarut yang lebih tinggi
PERSAMAAN (RUMUS) SIFAT KOLIGATIF LARUTAN
1. Penurunan Tekanan Uap :
2. Kenaikan Titik Didih:
3. Penurunan Titik Beku:
4. Tekanan Osmosis:
UNTUK MENGUJI KEMAMPUAN TENTANG MATERI INI, SILAHKAN KLIK




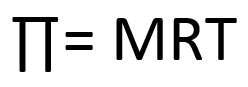
0 Response to "KIMIA-SIFAT KOLIGATIF LARUTAN-PERTEMUAN 1"
Posting Komentar